Psoriasi
Diagnosi e diagnosi differenziale
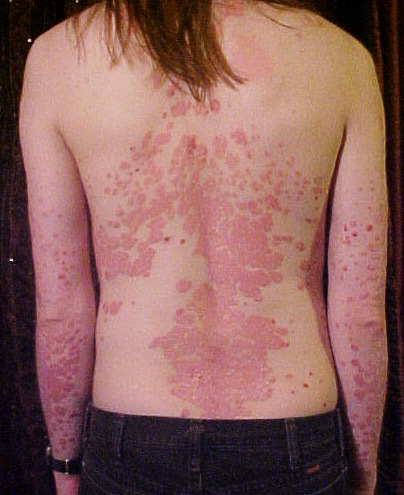
Diagnosi clinica: La diagnosi di psoriasi è in primo luogo clinica, basata sull’ispezione delle lesioni cutanee caratteristiche e sulla loro distribuzione. In un paziente tipico con placche eritemato-desquamative su superfici estensorie, con storia di decorso cronico-recidivante e magari familiarità positiva, la diagnosi è evidente. Elementi come il segno di Auspitz (sanguinamento puntiforme dopo grattamento della scala) e il fenomeno di Koebner supportano la diagnosi. Nelle forme atipiche o incerte, può essere indicata una biopsia cutanea: l’esame istologico mostrerà i reperti descritti (paracheratosi con microascessi, assenza di strato granuloso, acantosi psoriasiforme, ecc.) confermando la psoriasi. Non esistono esami di laboratorio specifici per la psoriasi; gli indici infiammatori (VES, PCR) possono essere normali o moderatamente elevati nei casi estesi. È importante però valutare la presenza di eventuali comorbidità (ad es. esami metabolici per sindrome metabolica, esami reumatologici se sospetto di artrite psoriasica, vedi oltre) e screening infettivologici prima di iniziare terapie sistemiche (es. test per TBC latente, epatiti, HIV prima dei biologici).
Diagnosi differenziale: In alcune situazioni, la psoriasi può essere confusa con altre dermatosi infiammatorie. È quindi fondamentale saper riconoscere le differenze principali rispetto a:
- Dermatite atopica/eczema cronico: nelle fasi croniche può presentare placche lichenificate e desquamanti, ma tipicamente con distribuzione flessurale (pieghe) nelle adulti, prurito più intenso e spesso con storia di atopia. L’eczema ha di solito margini meno netti e presenza di vescicole o essudazione nelle fasi acute, cose non tipiche della psoriasi.
- Dermatite seborroica: colpisce cuoio capelluto, volto (aree seborroiche) con chiazze eritematose e squame giallastre untuose. Esiste una forma di “sebopsoriasi” intermedia, ma in genere la dermatite seborroica non presenta le spesse placche argentee tipiche né l’estensione ad altre zone come gomiti/ginocchia.
- Pitiriasi rosea di Gibert: eruzione acuta autolimitante con chiazze ovalari a “medaglione” soprattutto su tronco, spesso orientate secondo le linee cutanee. Può ricordare una psoriasi guttata, ma la pitiriasi rosea ha una lesione madre iniziale, squame collarette periferiche e regressione spontanea in 6-8 settimane; inoltre non coinvolge tipicamente gomiti e ginocchia.
- Tinea corporis (dermatofizia): un’infezione fungina cutanea a placche può simulare la psoriasi in alcune sedi (es. una tinea su gomito). Tuttavia la tinea ha margini più attivi e spesso clearing centrale, può avere prurito intenso e migliora con antifungini topici (mentre la psoriasi peggiorerebbe con tali creme se cortison-free). L’esame microscopico (KOH) delle squame o la coltura micologica possono confermare la tinea.
- Lichen planus: dermatosi papulo-squamosa che produce papule violacee pruriginose e anche lesioni simili a placche; tuttavia, il lichen ha aspetto e distribuzione diversi (papule poligonali lucide, reticolo di Wickham, sedi come polsi, caviglie, mucose) e istologia differente (ipergranulosi, corpoidi, band-like infiltrate linfocitario dermico).
- Sifilide secondaria: può dare lesioni eritemato-squamose diffuse sul tronco e arti (roseola sifilitica) talora scambiabili per psoriasi guttata o pitiriasi rosea. Elementi a favore della sifilide: coinvolgimento di palme e piante, presenza di sintomi sistemici lievi, linfoadenopatie, e positività dei test sierologici (VDRL, TPHA). Nell’incertezza, una sifilide va sempre esclusa con esami, specie in caso di lesioni atipiche.
- Altre condizioni: la dermatite da contatto cronica (nelle mani) va distinta da psoriasi palmo-plantare; l’eczema nummulare dalle placche psoriasiche; negli anziani, istoplasmosi disseminata o altri esantemi possono simulare psoriasi; e soprattutto il linfoma cutaneo a cellule T (micosi fungoide) nelle fasi iniziali parapsoriasiche può essere scambiato per psoriasi a placche su tronco. In questi casi atipici, la biopsia cutanea e l’andamento clinico aiutano a differenziare.
In generale, la psoriasi mostra placche ben demarcate, di solito asintomatiche o moderatamente pruriginose, croniche e recidivanti. Una corretta diagnosi differenziale è importante anche perché alcune terapie (es. corticosteroidi) possono essere appropriate per eczemi ma controindicate in psoriasi sistemica, o viceversa.
Comorbidità associate
Originariamente considerata solo una malattia cutanea, oggi la psoriasi è riconosciuta come una patologia sistemica con possibili molteplici comorbidità. L’infiammazione cronica di basso grado che la caratterizza può infatti coinvolgere altri organi e favorire lo sviluppo di condizioni associate. Le principali comorbidità riconosciute includono:
- Artrite psoriasica (PsA): fino al 25-30% (alcuni studi riportano 30-40%) dei pazienti psoriasici svilupperà una forma di artrite infiammatoria correlata . L’artrite psoriasica è una spondiloartrite sieronegativa che può manifestarsi con diverse presentazioni: oligoartrite asimmetrica (coinvolgimento di poche articolazioni, spesso grosse articolazioni periferiche), poliartrite simmetrica (simile a un’artrite reumatoide sieronegativa), artrite interfalangea distale (interessamento caratteristico delle articolazioni distali delle dita, spesso con dattilite ossia “dita a salsicciotto”), artrite mutilante (rara forma distruttiva) e spondilite (coinvolgimento assiale, colonna e sacroiliache). In circa 2/3 dei casi, i sintomi cutanei precedono quelli articolari, ma talvolta l’artrite può precedere o comparire senza molte lesioni cutanee apparenti. I segni cutanei associati (psoriasi ungueale, pitting) sono fortemente suggestivi. È fondamentale identificare precocemente l’artrite psoriasica perché il trattamento tempestivo con DMARD o biologici può prevenire danni articolari permanenti.
- Sindrome metabolica e malattie cardiovascolari: la psoriasi, specialmente se moderata-severa, è associata a un aumento di rischio di sindrome metabolica (obesità addominale, diabete mellito tipo 2, dislipidemia e ipertensione). I pazienti psoriasici hanno prevalenza maggiore di obesità e indice di massa corporea elevato. L’infiammazione psoriasica cronica condivide pathway patogenetici con l’aterosclerosi (ad es. TNF, IL-17, IL-6) e potrebbe contribuire all’instabilizzazione delle placche aterosclerotiche. Studi hanno evidenziato che la psoriasi severa comporta un rischio cardiovascolare simile a quello del diabete di tipo 2 in termini di infarto. Pertanto, è importante monitorare e gestire aggressivamente i fattori di rischio cardiovascolare in questi pazienti (controllo di peso, pressione, glicemia, lipidici, dieta, fumo).
- Malattie infiammatorie croniche intestinali: esiste un’associazione documentata con il morbo di Crohn e la rettocolite ulcerosa. Psoriasi e IBD condividono predisposizione genetica (es. via IL-23) e meccanismi immunitari, e spesso farmaci come gli anti-TNF possono giovare a entrambe. I pazienti psoriasici hanno rischio leggermente aumentato di sviluppare IBD rispetto ai non psoriasici.
- Disturbi oculari: la psoriasi può interessare anche gli occhi in vari modi. Può causare blefarite cronica, congiuntivite e, raramente, uveite anteriore (più frequente nei pazienti con artrite psoriasica associata). Inoltre la malattia può portare a secchezza oculare. Un segno oculare comune è la blefarite con possibile ectropion cicatriziale se grave. È importante riconoscere l’eventuale uveite (dolore oculare, fotofobia, visione offuscata) perché necessita terapia oftalmologica urgente.
- Altre malattie autoimmuni: sebbene meno frequente dell’associazione con artrite, in alcuni pazienti psoriasici si riscontra una maggiore incidenza di altre condizioni immuno-mediate come celiachia, vitiligine, alopecia areata, tiroiditi autoimmuni. Ciò riflette probabilmente una predisposizione immunogenetica comune.
- Depressione, ansia e disturbi psichiatrici: l’impatto psicologico della psoriasi è notevole. Il 10-20% dei pazienti con psoriasi sviluppa sintomi depressivi clinicamente significativi, spesso correlati alla percezione di sé, all’impatto estetico delle lesioni e allo stigma sociale. Anche l’ansia è più comune rispetto alla popolazione generale. Nei casi gravi, si segnalano tassi aumentati di ideazione suicidaria. TNF, IL-17, IL-6) e potrebbe contribuire all’instabilizzazione delle placche aterosclerotiche. Studi hanno evidenziato che la psoriasi severa comporta un rischio cardiovascolare simile a quello del diabete di tipo 2 in termini di infarto. Pertanto, è importante monitorare e gestire aggressivamente i fattori di rischio cardiovascolare in questi pazienti (controllo di peso, pressione, glicemia, lipidici, dieta, fumo).
- Malattie infiammatorie croniche intestinali: esiste un’associazione documentata con il morbo di Crohn e la rettocolite ulcerosa. Psoriasi e IBD condividono predisposizione genetica (es. via IL-23) e meccanismi immunitari, e spesso farmaci come gli anti-TNF possono giovare a entrambe. I pazienti psoriasici hanno rischio leggermente aumentato di sviluppare IBD rispetto ai non psoriasici.
- Disturbi oculari: la psoriasi può interessare anche gli occhi in vari modi. Può causare blefarite cronica, congiuntivite e, raramente, uveite anteriore (più frequente nei pazienti con artrite psoriasica associata). Inoltre la malattia può portare a secchezza oculare. Un segno oculare comune è la blefarite con possibile ectropion cicatriziale se grave. È importante riconoscere l’eventuale uveite (dolore oculare, fotofobia, visione offuscata) perché necessita terapia oftalmologica urgente.
- Altre malattie autoimmuni: sebbene meno frequente dell’associazione con artrite, in alcuni pazienti psoriasici si riscontra una maggiore incidenza di altre condizioni immuno-mediate come celiachia, vitiligine, alopecia areata, tiroiditi autoimmuni. Ciò riflette probabilmente una predisposizione immunogenetica comune.
- Depressione, ansia e disturbi psichiatrici: l’impatto psicologico della psoriasi è notevole. Il 10-20% dei pazienti con psoriasi sviluppa sintomi depressivi clinicamente significativi, spesso correlati alla percezione di sé, all’impatto estetico delle lesioni e allo stigma sociale. Anche l’ansia è più comune rispetto alla popolazione generale. Nei casi gravi, si segnalano tassi aumentati di ideazione suicidaria TNF, IL-17, IL-6) e potrebbe contribuire all’instabilizzazione delle placche aterosclerotiche. Studi hanno evidenziato che la psoriasi severa comporta un rischio cardiovascolare simile a quello del diabete di tipo 2 in termini di infarto. Pertanto, è importante monitorare e gestire aggressivamente i fattori di rischio cardiovascolare in questi pazienti (controllo di peso, pressione, glicemia, lipidici, dieta, fumo).
- Malattie infiammatorie croniche intestinali: esiste un’associazione documentata con il morbo di Crohn e la rettocolite ulcerosa. Psoriasi e IBD condividono predisposizione genetica (es. via IL-23) e meccanismi immunitari, e spesso farmaci come gli anti-TNF possono giovare a entrambe. I pazienti psoriasici hanno rischio leggermente aumentato di sviluppare IBD rispetto ai non psoriasici.
- Disturbi oculari: la psoriasi può interessare anche gli occhi in vari modi. Può causare blefarite cronica, congiuntivite e, raramente, uveite anteriore (più frequente nei pazienti con artrite psoriasica associata). Inoltre la malattia può portare a secchezza oculare. Un segno oculare comune è la blefarite con possibile ectropion cicatriziale se grave. È importante riconoscere l’eventuale uveite (dolore oculare, fotofobia, visione offuscata) perché necessita terapia oftalmologica urgente.
- Altre malattie autoimmuni: sebbene meno frequente dell’associazione con artrite, in alcuni pazienti psoriasici si riscontra una maggiore incidenza di altre condizioni immuno-mediate come celiachia, vitiligine, alopecia areata, tiroiditi autoimmuni. Ciò riflette probabilmente una predisposizione immunogenetica comune.
- Depressione, ansia e disturbi psichiatrici: l’impatto psicologico della psoriasi è notevole. Il 10-20% dei pazienti con psoriasi sviluppa sintomi depressivi clinicamente significativi, spesso correlati alla percezione di sé, all’impatto estetico delle lesioni e allo stigma sociale. Anche l’ansia è più comune rispetto alla popolazione generale. Nei casi gravi, si segnalano tassi aumentati di ideazione suicidaria . Inoltre, alcuni pazienti possono sviluppare disturbi dell’adattamento, isolamento sociale o abuso di sostanze (alcool in primis) come meccanismi maladattivi. È fondamentale che il curante valuti il benessere psicologico e, se necessario, invii il paziente a supporto psicologico o psichiatrico. Il miglioramento della pelle con la terapia spesso porta anche beneficio all’umore, ma a volte è utile un approccio integrato dermatologo-psicologo.
- Sindrome delle apnee ostruttive del sonno (OSAS) e disturbi del sonno: studi recenti indicano una maggiore prevalenza di OSAS nei pazienti con psoriasi, forse correlata all’obesità e allo stato infiammatorio. In generale prurito e fastidio cutaneo possono disturbare il sonno notturno, contribuendo a stanchezza cronica.
- Neoplasie: la psoriasi in sé non è una condizione neoplastica, ma i pazienti possono avere un rischio lievemente maggiore di alcuni tumori, in parte per via dell’infiammazione cronica, in parte per effetti di terapie immunosoppressive. Ad esempio, è riportato un aumento di linfomi non Hodgkin in psoriasici trattati a lungo termine con alcuni immunosoppressori. Inoltre la fototerapia PUVA ad alte dosi cumulative aumenta il rischio di carcinoma cutaneo non-melanoma. In ogni caso, il rischio assoluto rimane basso e va bilanciato con i benefici delle terapie.
Le numerose comorbidità elencate evidenziano come la psoriasi sia più di una “semplice” malattia della pelle. Una gestione ottimale del paziente psoriasico richiede un approccio multidisciplinare: il dermatologo deve collaborare con il reumatologo per l’artrite, con l’internista/cardiologo per i fattori di rischio cardiovascolare, con lo psicologo/psichiatra per il supporto emotivo, ecc. Raccomandazioni internazionali suggeriscono di screenare regolarmente i pazienti psoriasici per: sintomi articolari (dolori, rigidità mattutina, gonfiori articolari), parametri metabolici (BMI, glicemia, profilo lipidico, pressione arteriosa), sintomi di depressione/ansia, segni di IBD, e fattori di rischio oncologici se in terapia immunosoppressiva. Questo consente di intercettare precocemente complicanze e trattarle in modo appropriato, migliorando la prognosi globale del paziente.
Linee guida diagnostiche e terapeutiche
Le linee guida internazionali (europee EADV/EDF “EuroGuiDerm”, americane AAD/NPF, britanniche NICE) concordano sul fatto che la gestione della psoriasi debba essere personalizzata in base alla gravità, alle caratteristiche del paziente e alle comorbidità. In generale, per la diagnosi non esistono criteri formalizzati dati i chiari aspetti clinici: le linee guida ribadiscono l’importanza della diagnosi clinica e della valutazione della qualità di vita (es. punteggio DLQI) per determinare l’impatto della malattia [oai_citation:61‡guidelines.edf.one](https://guidelines.edf.one//uploads/attachments/clpb19l7t20h9dtjrscvcuem7-2-disease-severity-treatment-goals-sep-2023.pdf#:~:text=Health%20related%20quality%20of%20life,and%20burden%20psoriasis%20treatment%202) [oai_citation:62‡guidelines.edf.one](https://guidelines.edf.one//uploads/attachments/clpb19l7t20h9dtjrscvcuem7-2-disease-severity-treatment-goals-sep-2023.pdf#:~:text=conducted%20in%202011%203,two%20fingernails%2C%20presence%20of%20itch). La biopsia cutanea è riservata ai casi dubbi, come già detto. Viene raccomandato di valutare sempre la presenza di artrite psoriasica (utilizzando eventualmente questionari di screening come il PEST – Psoriasis Epidemiology Screening Tool) e di tenere monitorati nel follow-up gli indici metabolici e cardiovascolari, integrando il trattamento cutaneo con misure preventive sistemiche (dieta, attività fisica, ecc.).
Per quanto riguarda il trattamento, linee guida autorevoli definiscono criteri per l’utilizzo delle diverse terapie disponibili. Un concetto chiave è la suddivisione tra malattia “lieve” vs “moderata-severa” che orienta la scelta terapeutica. In Europa, ad esempio, la consensus EDF/EADV definisce psoriasi moderata-severa se PASI superiore a 10 o BSA superiore a 10% e DLQI superiore a 10, oppure in caso di interessamento di aree particolari (viso, mani, genitali, unghie) o sintomi refrattari. In tali casi è indicata una terapia sistemica. Viceversa la psoriasi lieve (PASI, BSA e DLQI tutti ≤10) può essere gestita con terapie topiche e fototerapia.
Le linee guida europee (EuroGuiDerm/EADV), aggiornate di recente, enfatizzano un approccio “treat-to-target”: si stabiliscono obiettivi terapeutici chiari (ad esempio riduzione del PASI del 75% o più) entro un certo periodo (in genere 3-6 mesi) e se non vengono raggiunti, si deve considerare un cambio o escalation della terapia. In particolare, viene suggerito di valutare la risposta a 3 mesi dall’inizio di una terapia sistemica: un miglioramento PASI50 (riduzione del PASI del 50%) è considerato inadeguato (failure) e dovrebbe portare a modificare trattamento; un miglioramento PASI 50-75 può essere accettabile solo se accompagnato da un chiaro beneficio sulla qualità di vita (DLQI migliorato), altrimenti si considera anch’esso subottimale. L’obiettivo ideale è ottenere PASI 90 o clearance completa (clear/almost clear) in modo da massimizzare anche il benessere del paziente. Questo approccio è reso possibile dalle terapie moderne molto efficaci (biologici).
Le linee guida dell’American Academy of Dermatology (AAD), in collaborazione con il National Psoriasis Foundation (NPF), forniscono raccomandazioni simili. Sottolineano la valutazione iniziale della severità (includendo anche criteri come il coinvolgimento di aree critiche per definire la psoriasi “candidata a sistemica”) e poi un approccio graduale: terapie topiche per i casi lievi, fototerapia o sistemiche tradizionali per i moderati, e farmaci biologici per i casi moderati-gravi soprattutto se la psoriasi è diffusa o artropatica [oai_citation:69‡ncbi.nlm.nih.gov](https://www.ncbi.nlm.nih.gov/books/NBK448194/#:~:text=1,BSA%20is%20involved) [oai_citation:70‡ncbi.nlm.nih.gov](https://www.ncbi.nlm.nih.gov/books/NBK448194/#:~:text=5,Secukinumab%20is%20another%20alternative). Le linee guida AAD/NPF aggiornate includono anche raccomandazioni sull’uso di nuovi farmaci orali (es. apremilast, deucravacitinib) e biologici di ultima generazione, oltre a indicazioni sulla gestione delle comorbidità. Ad esempio, raccomandano screening annuale della depressione e valutazione del BMI e sindrome metabolica, come parte integrante del follow-up.
Le linee guida NICE britanniche forniscono criteri restrittivi soprattutto per l’accesso ai farmaci più costosi (biologici). Ad esempio, NICE raccomanda l’uso di un farmaco biologico in pazienti adulti con psoriasi a placche cronica grave definita da PASI uguale o superiore a 10 e DLQI superiore a 10, che non abbiano risposto ad almeno due terapie sistemiche convenzionali (o le abbiano controindicate). Ogni farmaco biologico approvato da NICE viene accompagnato da una technology appraisal che ne specifica le condizioni d’uso. Ad esempio, di recente NICE ha approvato il deucravacitinib (un nuovo inibitore di TYK2 orale) come opzione per la psoriasi moderata-grave in adulti che non hanno risposto ad altre sistemiche, prevedendo di sospenderlo se non si ottiene almeno PASI50 entro 3-6 mesi di terapia. Simili linee valgono per gli altri biologici: va documentata una riduzione significativa del PASI (tipicamente ≥75%) per giustificarne la continuazione, altrimenti si valuta un farmaco alternativo.
Le linee guida di diverse regioni concordano anche su alcune precauzioni: ad esempio, prima di iniziare terapie sistemiche immunosoppressive è obbligatorio escludere TBC latente, epatite B/C, HIV; durante i biologici evitare vaccini vivi attenuati e aggiornare il calendario vaccinale prima possibile. Inoltre, alcuni farmaci hanno controindicazioni specifiche: gli anti-TNF vanno evitati in pazienti con scompenso cardiaco avanzato o con storia di demielinizzazione (SM); il methotrexate è sconsigliato se fegato compromesso o gravidanza; la ciclosporina va evitata in ipertesi non controllati o con insufficienza renale; i retinoidi (acitretina) sono altamente teratogeni e controindicati in donne fertili non adeguatamente contraccettivate, ecc.
In sintesi, le linee guida attuali promuovono un approccio terapeutico personalizzato e proattivo: scegliere il trattamento adeguato al paziente (tenendo conto di gravità cutanea, presenza di artrite, comorbidità, preferenze e stile di vita), fissare obiettivi di miglioramento clinico e monitorare la risposta, modificando tempestivamente la strategia se i target non sono raggiunti. Grazie a questa filosofia, oggi l’obiettivo in psoriasi non è più solo “migliorare un po’” ma puntare alla quasi completa clearance delle lesioni, migliorando sensibilmente la qualità di vita dei pazienti.
Approccio terapeutico
Il trattamento della psoriasi si basa su diverse modalità terapeutiche che possono essere utilizzate da sole o in combinazione, a seconda della gravità e delle caratteristiche del paziente. Le opzioni comprendono terapie topiche, fototerapia, terapie sistemiche tradizionali (farmaci orali o iniettivi non-biologici) e i farmaci biologici mirati (iniettivi). Di seguito una panoramica di ciascun approccio:
Terapie topiche
Rappresentano il primo livello di trattamento, indicato per psoriasi di grado lieve o per lesioni localizzate (anche come coadiuvante in casi più estesi). I principali trattamenti topici includono:
- Corticosteroidi topici: Sono il cardine della terapia locale. Hanno potente azione antinfiammatoria e immunosoppressiva locale. Si utilizzano steroidi di potenza variabile a seconda della sede e spessore delle lesioni: ad esempio, corticosteroidi ad alta potenza (clobetasolo propionato, betametasone dipropionato) per gomiti, ginocchia, tronco; potenza media per aree più delicate o in mantenimento; bassa potenza per volto, pieghe o uso prolungato. Si applicano 1-2 volte/die per cicli brevi nelle fasi attive, poi in modalità intervallata (“weekend therapy” o calo graduale) per minimizzare gli effetti collaterali. Possibili effetti indesiderati locali: atrofia cutanea, teleangectasie, ipopigmentazione; per assorbimento sistemico (raro in psoriasi se uso controllato) soppressione asse HPA, ecc. Restano comunque tra le terapie più efficaci per ridurre rapidamente l’eritema e la desquamazione delle placche.
- Analoghi della vitamina D3 (calcipotriolo, calcitriolo, tacalcitolo): Questi composti normalizzano la differenziazione cheratinocitaria e hanno effetto antiproliferativo/immunomodulante. Spesso usati in associazione o alternanza con steroidi topici. Una combinazione fissa molto diffusa è betametasone + calcipotriolo in unguento o gel, da applicare una volta al giorno: l’associazione aumenta l’efficacia e riduce gli effetti collaterali rispetto ai singoli componenti. Gli analoghi vit D possono causare lieve irritazione locale; raramente alterazioni del calcio se applicati su superfici estese. Sono indicati soprattutto per mantenimento e in pazienti in cui si vuole ridurre l’uso di steroidi.
- Catrame di carbone (coal tar) e dithranol (antralina): Sono terapie topiche “tradizionali” con effetti antiproliferativi. Il catrame, in shampoo o creme, può essere utile per il cuoio capelluto o come coadiuvante (ha anche effetto cheratolitico). Il dithranol è efficace ma molto irritante e macchia la pelle e gli indumenti; oggi poco usato, riservato a protocolli in ospedale (es. terapia di Goekerman: dithranol + UV). Questi rimedi sono caduti in disuso rispetto a steroidi e derivati vit D per praticità.
- Retinoidi topici: Il tazarotene (derivato della vitamina A) in gel o crema allo 0,05-0,1% è indicato per psoriasi a placche lieve (spesso volto) o come coadiuvante. Agisce normalizzando la crescita dei cheratinociti. Può causare irritazione e va evitato in gravidanza. Spesso lo si usa in combinazione con corticosteroidi topici (per aumentarne l’effetto e ridurre l’irritazione).
- Inibitori della calcineurina topici: Tacrolimus unguento e pimecrolimus crema, sebbene indicati per dermatite atopica, vengono impiegati off-label nelle sedi dove i corticosteroidi sono meno indicati, ad esempio psoriasi del viso o psoriasi invertita nelle pieghe, per evitare atrofia cutanea. Hanno effetto immunomodulante (bloccano l’attivazione dei linfociti T) e possono aiutare a mantenere la remissione in aree delicate.
- Emollienti e cheratolitici: Prodotti idratanti (creme con urea, acido salicilico, paraffina ecc.) sono molto utili come coadiuvanti. Mantenere la pelle ben idratata riduce la desquamazione, il prurito e aiuta a ripristinare la barriera cutanea. L’acido salicilico (es. in lozione 5-10%) è un ottimo cheratolitico per rimuovere le squame spesse, soprattutto sul cuoio capelluto, migliorando la penetrazione degli altri topici. Può essere usato anche in associazione con catrame (es. lozioni al 2-5% di acido salicilico in soluzione di catrame).
Le terapie topiche, pur essendo efficaci per malattia limitata, diventano impraticabili se la psoriasi coinvolge aree molto estese (oltre 10-20% del corpo). Inoltre la compliance del paziente è fondamentale: applicazioni quotidiane prolungate possono essere difficili da mantenere. Per estensioni maggiori o malattia resistente ai topici, si passa a fototerapia o terapie sistemiche.
Fototerapia
La fototerapia sfrutta gli effetti immunomodulanti delle radiazioni ultraviolette (UV) per trattare la psoriasi. È indicata per psoriasi di grado moderato (soprattutto se estesa oltre il 10-15% BSA) o in caso di intolleranza/controindicazioni alle terapie sistemiche. Le modalità principali sono:
- UVB a banda stretta (NB-UVB, 311 nm): Attualmente la fototerapia di elezione per psoriasi. Consiste nell’esposizione del paziente a raggi UVB a 311 nm, emessi da speciali lampade fluorescenti, in cabine dedicate. Si eseguono sedute 2-3 volte a settimana, incrementando gradualmente la dose in base alla tolleranza, per un totale di ~20-30 sedute a ciclo. L’NB-UVB induce apoptosi dei linfociti T nella cute e normalizza la proliferazione cheratinocitaria. È efficace in molte forme: ottima per psoriasi guttata, placche diffuse; meno per pustolosa o eritrodermica. Ha un profilo di sicurezza buono: il rischio principale è l’eritema/ustione da UV se dosaggio eccessivo, e a lungo termine un moderato aumento di rischio di tumori cutanei (molto inferiore rispetto alla PUVA). Può essere usata anche in combinazione con retinoidi (Re-UVB) per potenziarne l’effetto.
- PUVA (Psoralen + UVA): Metodo più vecchio, oggi usato meno per gli effetti collaterali cumulativi. Si somministra un fotosensibilizzante (psoralene, es. 8-MOP) per via orale o locale, e dopo 1-2 ore si espone la cute a raggi UVA (320-400 nm). L’effetto è potente (PUVA è molto efficace per psoriasi spesse, palmo-plantari, ecc.) ma l’uso cronico è associato a invecchiamento cutaneo e soprattutto aumento del rischio di carcinoma squamocellulare e melanoma. Si riserva a casi gravi o resistenti, o a varianti particolari (es. psoriasi palmo-plantare). Esiste anche la PUVA-bagno (psoralene disciolto in vasca, assorbito tramite la cute) utile per risparmiare effetti sistemici.
- Fototerapia laser o mirata: per placche localizzate, ad esempio su ginocchia, gomiti, può essere usato l’Excimer laser 308 nm (una forma di UVB mirata) che tratta piccole aree evitando di esporre tutta la cute. Utile per poche lesioni ostinate o per zone come palmi/piante.
La fototerapia può portare a remissione o netto miglioramento in 1-2 mesi di trattamento. Spesso, però, le recidive avvengono entro mesi dall’interruzione. Può essere integrata con terapie topiche (ad esempio calcipotriolo) per sinergizzare l’effetto. È controindicata in pazienti con anamnesi di melanoma o alto rischio di tumori cutanei, e va usata cautela in chi assume farmaci fotosensibilizzanti. Un aspetto pratico è che richiede la disponibilità del paziente a recarsi frequentemente in ospedale/centro per le sedute.
Terapie sistemiche tradizionali
Comprendono vari farmaci per via orale o iniettiva non biologici, indicati per psoriasi moderata-grave o che coinvolge aree estese/delicate, specialmente se non adeguatamente controllata con topici o fototerapia. I principali sono:
- Methotrexate (MTX): antimetabolita (analogo dell’acido folico) con azione immunosoppressiva, considerato il gold standard tradizionale per psoriasi estesa e/o artropatica. Si somministra una volta a settimana (dosi tipiche 7,5–20 mg settimanali) per os o sottocute. Efficace nel controllare sia le lesioni cutanee sia l’artrite psoriasica. Va assunto con supplementazione di acido folinico per ridurre gli effetti collaterali. Principali rischi: epatotossicità (monitorare transaminasi; attenzione a consumo di alcool e co-morbidità epatiche), mielosoppressione (controllo emocromo), teratogenicità (categoricamente controindicato in gravidanza; richiede contraccezione efficace durante e fino a ~6 mesi dopo terapia). Non va usato in pazienti con insufficienza renale grave (escrezione renale). Nonostante questi accorgimenti, il MTX è economico e spesso ben tollerato a basse dosi, ed è raccomandato come primo-line sistemico in molte linee guida europee per psoriasi severa, soprattutto in assenza di controindicazioni. Spesso viene scelto se il paziente ha anche artrite.
- Ciclosporina (CyA): potente immunosoppressore che inibisce preferenzialmente i linfociti T (calcineurina-inibitore). È molto efficace per psoriasi, con risposta rapida (in 4-6 settimane può indurre remissione). Si usa soprattutto in cicli a breve termine (alcuni mesi) per controllare crisi acute o psoriasi eritrodermica/pustolosa, o come “ponte” in attesa che altri farmaci agiscano. Dose indicativa 3-5 mg/kg/die per os, frazionata in due dosi. Limita l’uso a lungo termine la sua tossicità: nefrotossicità (aumenta creatinina, rischio di insufficienza renale cronica), ipertensione (monitorare pressione; controindicato in ipertesi non controllati), rischio di ipertricosi, iperplasia gengivale, e aumentato rischio di tumori cutanei (soprattutto se storia di PUVA). Richiede monitoraggio della funzionalità renale e pressione ogni 2 settimane inizialmente. Secondo linee guida, la ciclosporina è da preferire per esempio in psoriasi severa di rapida insorgenza o in pazienti con epatopatie (dove MTX è controindicato) ma va evitata se il paziente ha già rischio cardiovascolare elevato (ipertesi, dislipidemici non controllati).
- Retinoidi orali (Acitretina): derivato della vitamina A, utile soprattutto nella psoriasi pustolosa e nella forma eritrodermica, oppure in combinazione con fototerapia (Re-PUVA). Dose ~0.3-0.5 mg/kg/die. Non è un immunosoppressore, ma normalizza la differenziazione epidermica. Spesso usato quando altre sistemiche sono controindicate (ad esempio in pazienti HIV+ o con infezioni attive, perché non deprime l’immunità). Il vantaggio è che non provoca immunosoppressione sistemica; gli svantaggi: efficacia moderata nella psoriasi a placche (spesso non sufficiente in monoterapia), secchezza delle mucose come effetto collaterale quasi universale, dislipidemia (può aumentare trigliceridi), epatotossicità. Soprattutto è altamente teratogeno: è assolutamente controindicato in gravidanza e nelle donne in età fertile che non pratichino contraccezione efficace; l’acitretina persiste a lungo nell’organismo, quindi va evitata gravidanza per almeno 2 anni dopo la sospensione. Negli uomini non dà problemi di teratogenicità. In soggetti idonei (es. maschi o donne non fertili) con forme pustolose estese, può essere estremamente utile.
- Apremilast: farmaco orale non biologico di recente introduzione, inibitore selettivo della fosfodiesterasi-4 (PDE4). Riduce la produzione di citochine infiammatorie (TNF-α, IL-17, IL-23) modulando i mediatori intracellulari. Indicato per psoriasi da moderata a grave e per l’artrite psoriasica, specialmente in pazienti che non tollerano o non possono assumere MTX o biologici. Dose 30 mg 2 volte/die per os. Ha un profilo di sicurezza favorevole: non richiede monitoraggi ematochimici frequenti, essendo privo di tossicità d’organo importante. Effetti collaterali principali: disturbi gastro-intestinali (diarrea, nausea) specialmente inizialmente, e possibile calo ponderale. Alcuni pazienti riferiscono cefalea o umore depresso (va monitorato l’umore). L’efficacia è intermedia: circa 20% dei pazienti raggiunge PASI75, quindi meno dei biologici ma utile in casi selezionati. Il vantaggio è la via orale e la relativa sicurezza.
- Esteri fumarici (Dimetilfumarato e Sali correlati): usati da tempo in Germania, introdotti anche altrove (in Italia dimetilfumarato è registrato per psoriasi moderata-grave come “Skilarence”). Agiscono con effetto immunomodulante e antinfiammatorio (inducono uno shift anti-infiammatorio dei linfociti). Si utilizzano per via orale in dosi crescenti. Possono essere efficaci in forma moderata, con profilo di sicurezza accettabile. Effetti avversi comuni: flushing, disturbi gastrointestinali, linfopenia (richiede monitoraggio emocromocitometrico). Sono una opzione in pazienti che non possono fare altre terapie per comorbidità, benché la loro efficacia sia modesta rispetto ai biologici.
- Altri: i corticosteroidi sistemici (es. prednisone) in generale andrebbero evitati nel trattamento della psoriasi, sia perché non indicati (possono paradossalmente peggiorare la malattia una volta sospesi, scatenando forme eritrodermiche o pustolose), sia per i loro noti effetti collaterali metabolici. Possono essere considerati solo in circostanze eccezionali (es. concomitante artrite psoriasica gravissima non controllata, o come “salvataggio” in eritrodermia acuta mentre si avvia un’altra terapia), ma sempre con estrema cautela e prevedendo uno scalaggio lentissimo. Altri immunosoppressori come le tiopurine (azatioprina), leflunomide, micofenolato sono stati utilizzati off-label in alcuni casi di psoriasi, ma con evidenze limitate; non sono terapie di prima linea ma solo di nicchia quando le altre opzioni falliscono o non sono praticabili.
Terapie biologiche e piccole molecole mirate
Negli ultimi 15-20 anni, i farmaci biologici hanno rivoluzionato il trattamento della psoriasi moderata-grave. Si tratta di anticorpi monoclonali o proteine di fusione ingegnerizzate che bloccano selettivamente specifici bersagli del processo immunitario psoriasico (citochine o loro recettori). La loro efficacia è elevata: la maggior parte dei pazienti ottiene miglioramenti superiore al 75% (PASI75) e in molti casi pelle quasi completamente libera da lesioni (PASI90-100), con miglioramento significativo della qualità di vita. I principali biologici approvati per psoriasi sono:
- Inibitori del TNF-α: i “pionieri” tra i biologici. Comprendono etanercept (recettore solubile TNF p75 Fc-fusione), adalimumab (anticorpo monoclonale anti-TNF umano), infliximab (anticorpo chimerico anti-TNF, somministrato EV) e certolizumab pegol (frammento Fab anti-TNF pegilato, privo di frammento Fc). Questi farmaci bloccano il TNF-α, una citochina centrale nell’infiammazione psoriasica e artropatica. Hanno dimostrato grande efficacia sia sulle placche cutanee sia sull’artrite. Adalimumab e infliximab in particolare spesso portano a PASI90 in percentuali alte di pazienti. Tuttavia, l’uso del TNF-inibitori può essere limitato da effetti collaterali: aumentato rischio di infezioni (specialmente TBC latente, per questo screening tubercolosi obbligatorio), possibili fenomeni autoimmuni indotti (es. lupus-like syndrome), scompenso di insufficienza cardiaca congestizia (controindicati in classi NYHA III-IV), e raramente eventi demielinizzanti. Nel tempo, alcuni pazienti possono perdere risposta per anticorpi anti-farmaco (soprattutto con infliximab). Oggi, con l’avvento di biologici mirati a IL-17/23, gli anti-TNF sono un po’ meno utilizzati di prima linea, ma restano validi soprattutto se coesiste artrite psoriasica significativa (dove hanno ampie evidenze).
- Inibitore di IL-12/23 (p40): Ustekinumab è un anticorpo monoclonale diretto contro la subunità p40 condivisa da IL-12 e IL-23. È stato uno dei primi biologici specifici per psoriasi, efficace sia su cute che articolazioni. Si somministra SC ogni 12 settimane (dopo due dosi iniziali ravvicinate). Ha un profilo di sicurezza favorevole e comodità posologica. Viene considerato ancora una ottima opzione, sebbene gli anti-IL17/23 più nuovi abbiano dimostrato in studi testa-a-testa efficacia maggiore. Ustekinumab rimane però preferito in alcuni casi (ad esempio, pazienti con malattie infiammatorie intestinali concomitanti, data la sua efficacia anche sul Crohn) e in linee guida precedenti era il biologico di prima scelta generale (oggi la scelta è più sfumata in base alle caratteristiche del paziente).
- Inibitori di IL-17A (e IL-17F): Le citochine IL-17A e IL-17F prodotte dai linfociti Th17 sono centrali nella patogenesi. Abbiamo diversi farmaci: Secukinumab e Ixekizumab sono anticorpi anti-IL-17A, mentre Brodalumab è un anticorpo contro il recettore IL-17RA (bloccando così IL-17A/F). Inoltre recentemente è stato approvato Bimekizumab, che è un anticorpo duale anti-IL-17A e IL-17F. Questi farmaci hanno mostrato tassi di risposta molto elevati (anche PASI100 in una quota significativa). Agiscono rapidamente (secukinumab e ixekizumab spesso migliorano le lesioni già entro 2 settimane). Si somministrano per via sottocutanea (ad es. secukinumab 300 mg mensile dopo induzione). Effetti collaterali: predisposizione a infezioni mucocutanee da candida (IL-17 è implicata nella difesa anti-fungina, quindi bloccandolo si può vedere più candidosi orale/genitale), e raramente insorgenza di malattie infiammatorie intestinali de-novo (da usare con cautela se il paziente ha IBD). Richiedono comunque screening TB pre-terapia. Hanno dimostrato efficacia anche nell’artrite psoriasica (secukinumab è approvato anche per quella). In molti paesi sono ora tra i biologici di prima linea per psoriasi grave per la loro potente efficacia.
- Inibitori di IL-23 (subunità p19): Sono gli ultimi arrivati e comprendono Guselkumab, Risankizumab, Tildrakizumab. Bloccare specificamente IL-23 (p19) arresta la cascata Th17 a monte, ma lascia intatta IL-12 (quindi teoricamente minor interferenza con risposte Th1 antivirali). Questi farmaci hanno mostrato efficacia eccellente e sostenuta: molti pazienti mantengono la remissione a lungo con iniezioni ogni 8-12 settimane. Guselkumab e Risankizumab in particolare hanno percentuali elevate di PASI90-100 mantenute nel tempo. Profilo di sicurezza molto buono: simile placebo per infezioni gravi, nessun segnale significativo finora su malattie demielinizzanti o tumori, anche se naturalmente serve monitoraggio a lungo termine. Gli anti-IL23 sono particolarmente utili in pazienti con risposta subottimale ad anti-TNF o anti-IL17. Hanno anche efficacia su artrite psoriasica (guselkumab approvato anche per PsA, benché leggermente meno potente su articolazioni rispetto ad anti-TNF).
In generale, la scelta del biologico dipende da molte variabili: presenza di artrite (dove TNF o IL-17 sono ben studiati), comorbidità (es. storia di IBD favorisce ustekinumab o anti-IL23; scompenso cardiaco esclude anti-TNF; paziente obeso: anti-IL17/23 non risentono del peso mentre alcuni studi suggeriscono minore efficacia di ustekinumab nei molto obesi), preferenze del paziente su frequenza di iniezioni, costo e rimborsabilità, ecc. La tendenza attuale è iniziare direttamente con un biologico di ultima generazione nei pazienti con psoriasi molto grave o che richiedono remissione rapida, data la loro sicurezza ed efficacia. Alcune linee guida (es. in Francia, Regno Unito) possono richiedere di provare prima terapie tradizionali (MTX, ciclosporina) a meno di controindicazioni, prima di passare ai biologici.
Un’ulteriore novità è rappresentata dalle small molecules mirate orali oltre ad apremilast menzionato sopra. Recentemente, ad esempio, è stato approvato il Deucravacitinib, inibitore selettivo di TYK2 (tirosina chinasi 2, coinvolta nelle vie di IL-23 e IFN di tipo I). È un piccolo farmaco orale, da assumere una volta al giorno, con efficacia superiore ad apremilast (in studi clinici ha portato ~50% di PASI75 a 16 settimane) e un profilo di sicurezza discreto (qualche rialzo di enzimi epatici e colesterolo, infezioni delle alte vie respiratorie). Deucravacitinib offre un’opzione in più per chi preferisce la via orale e potrebbe colmare il gap tra apremilast e i biologici in termini di efficacia. Altri JAK-inibitori orali (tofacitinib, baricitinib) non sono approvati per la psoriasi cutanea (tofacitinib lo è per l’artrite psoriasica), a causa di un rapporto rischio/beneficio non nettamente favorevole.
In conclusione, l’approccio terapeutico alla psoriasi richiede spesso di combinare e sequenziare le terapie: ad esempio un paziente può iniziare con MTX, poi passare a un biologico se la risposta è insufficiente, continuare col biologico per anni finché efficace; oppure un altro può usare topici e fototerapia per anni e solo in seguito aver bisogno di sistemiche. L’importante è adeguare il trattamento all’andamento della malattia e alle esigenze del paziente, sempre monitorando sicurezza ed efficacia. L’obiettivo è una pelle libera o quasi libera da lesioni (clear or almost clear) e mantenere questo risultato nel tempo, minimizzando gli effetti collaterali.
Monitoraggio e follow-up
La gestione della psoriasi è cronica e richiede un attento follow-up. Gli obiettivi del monitoraggio sono molteplici:
- Valutare l’efficacia della terapia: Ad ogni visita si dovrebbero documentare l’estensione e l’aspetto delle lesioni (tramite punteggi standardizzati come PASI – Psoriasis Area and Severity Index, BSA% coinvolta, PGA – Physician’s Global Assessment). Anche il paziente dovrebbe riferire il proprio DLQI (Dermatology Life Quality Index) o comunque fornire un feedback sulla qualità di vita. Questo permette di capire se gli obiettivi terapeutici (es. PASI75) sono stati raggiunti. In caso contrario, come da linee guida EADV, si valuta un potenziamento o cambio di terapia. Le linee guida internazionali raccomandano di fissare un target (es. PASI ≤3 o riduzione ≥75%) e di modificare il trattamento se dopo 3-6 mesi non vi è almeno una risposta parziale significativa (≥50% miglioramento). Strumenti semplici come la stima percentuale di cute affetta o foto comparative possono aiutare nel monitoraggio, specie in contesti ambulatoriali.
- Monitorare la sicurezza delle terapie: Ogni terapia sistemica ha dei potenziali effetti collaterali che vanno sorvegliati. Ad esempio, per chi assume methotrexate si faranno controlli periodici di emocromo, transaminasi ed eventualmente fibroscan epatico dopo lungo termine. Con la ciclosporina vanno misurati frequentemente creatinina e pressione arteriosa. L’acitretina richiede monitoraggio di profilo lipidico ed enzimi epatici. I biologici necessitano di controllo clinico di segni di infezioni (tubercolosi attiva, epatiti) e, nel caso di anti-TNF, attenzione a sintomi neurologici o cardiaci nuovi. Inoltre, tutte le terapie sistemiche immunosoppressive richiedono di aggiornare gli screening neoplastici di routine (es. pap test, colonoscopia secondo età) e di evitare vaccini vivi durante il trattamento [oai_citation:87‡ncbi.nlm.nih.gov](https://www.ncbi.nlm.nih.gov/books/NBK448194/#:~:text=8,agent%20should%20start%20effective%20contraception). Il dermatologo deve stilare un piano di monitoraggio specifico per il farmaco utilizzato e per le condizioni del paziente.
- Gestione delle comorbidità: Durante il follow-up vanno monitorati e gestiti i vari aspetti correlati: screening annuale/metrico di glicemia, profilo lipidico, BMI e pressione per la sindrome metabolica; valutazione periodica di dolori articolari o rigidità per intercettare un’eventuale artrite psoriasica insorgente (se sospetta, invio al reumatologo); controllo di segni di depressione o ansia (anche con domande dirette al paziente o questionari) e indirizzo a supporto psicologico se necessario. Un follow-up multidisciplinare (dermatologo, medico di base, eventualmente reumatologo, cardiologo, nutrizionista) migliora gli esiti a lungo termine.
- Adesione terapeutica e educazione: Il controllo periodico serve anche a rafforzare l’alleanza terapeutica col paziente. Si verificano eventuali difficoltà nel seguire la terapia (es. effetti collaterali intollerabili, problemi pratici nell’applicare topici o nel recarsi a fototerapia, ecc.) per trovare soluzioni. Si educa il paziente a riconoscere i segni precoci di ricaduta e a non scoraggiarsi se la malattia oscilla, ma a contattare il medico per aggiustare la cura. Inoltre, il follow-up è occasione per ribadire l’importanza degli stili di vita: cessazione del fumo, riduzione peso, attività fisica, dieta sana e moderazione con l’alcool, che possono tutti contribuire a migliorare la psoriasi o almeno a ridurre i rischi associati.
La frequenza delle visite dipende dalla gravità e dalla terapia in corso. In generale, un paziente in terapia sistemica viene rivisto dopo 1-3 mesi dall’inizio per valutare la risposta e gli esami di laboratorio, poi ogni 3-6 mesi se stabile. Chi è in trattamento topico può essere controllato ogni 4-6 mesi se va bene, o prima se servono aggiustamenti. Le visite dovrebbero includere l’ispezione di tutte le sedi tipiche (compreso cuoio capelluto, unghie, pieghe) e la palpazione delle articolazioni periferiche per cogliere eventuali segni di artrite. Un ruolo importante possono averlo gli infermieri specializzati in psoriasi, che in alcuni centri seguono i pazienti per l’educazione sul corretto uso dei farmaci (ad es. iniezioni dei biologici) e fanno da riferimento per dubbi tra una visita e l’altra.
In sintesi, il follow-up deve essere proattivo: non solo controllare la pelle, ma monitorare tutto l’insieme della salute del paziente psoriasico, adattando la strategia terapeutica quando necessario. Solo così si può garantire un controllo ottimale a lungo termine di una patologia cronica e sistemica quale è la psoriasi.
Aspetti psicologici e qualità di vita
La psoriasi ha un impatto profondo sulla qualità di vita dei pazienti, spesso paragonabile a quello di malattie croniche come diabete o cardiopatie. Le manifestazioni cutanee visibili possono infatti influenzare la sfera psicologica, le relazioni sociali e affettive e la vita lavorativa. Gli aspetti psicologici principali da considerare sono:
- Immagine corporea e autostima: placche estese o localizzate in aree visibili (viso, mani) possono indurre nel paziente sentimenti di imbarazzo, vergogna e bassa autostima. Molti pazienti si preoccupano dello sguardo altrui, evitano situazioni come piscine, palestre o altre occasioni sociali in cui la pelle è esposta. Questo condizionamento può portare all’isolamento sociale e incidere sulle attività quotidiane.
- Stress e psoriasi: c’è un circolo vizioso tra stress psicologico e andamento della malattia. Lo stress può scatenare o peggiorare la psoriasi, e al contempo la psoriasi provoca stress nel paziente. Tecniche di gestione dello stress (mindfulness, supporto psicologico, tecniche di rilassamento) possono aiutare a spezzare questo circolo.
- Depressione e ansia: come già accennato nelle comorbidità, i disturbi dell’umore sono più frequenti nei pazienti psoriasici. Il prurito e il fastidio fisico cronico, uniti al disagio estetico, possono portare a depressione clinica. L’ansia sociale è comune (paura del giudizio altrui, convinzione che la gente pensi che la psoriasi sia contagiosa). Importante è creare un ambiente di ascolto: il paziente deve sentirsi libero di esprimere il proprio disagio psicologico. In alcuni casi è opportuno coinvolgere uno psicologo o psichiatra per valutare terapie specifiche (psicoterapia, farmaci antidepressivi o ansiolitici). Studi hanno evidenziato che trattare efficacemente la psoriasi cutanea spesso migliora anche i sintomi depressivi, a riprova del legame tra pelle e psiche.
- Qualità di vita: viene misurata anche attraverso indici come il DLQI. Nei casi severi di psoriasi, il DLQI può essere molto alto (indicando impatto estremamente grave su vita quotidiana). I problemi quotidiani includono: prurito persistente che disturba il sonno, disagi nel vestirsi (le squame che cadono possono imbrattare vestiti, lenzuola), limitazioni lavorative (es. psoriasi su mani può limitare chi fa lavori manuali o a contatto col pubblico), difficoltà nelle relazioni intime (psoriasi genitale o diffusa che causa imbarazzo col partner). A livello familiare, il partner o i familiari possono non comprendere appieno il peso della malattia, quindi l’educazione anche dei caregiver è importante. Gruppi di supporto tra pazienti, associazioni (come l’ADIPSO in Italia) possono fornire condivisione di esperienze e ridurre il senso di isolamento.
- Stigma sociale: nonostante la psoriasi non sia contagiosa, spesso chi ne è affetto percepisce o subisce comportamenti stigmatizzanti (sguardi, domande invadenti, o anche evitamento da parte di persone che temono erroneamente il contagio). Questo stigma può essere combattuto con l’informazione: molti pazienti trovano utile spiegare apertamente a colleghi o conoscenti cosa sia la psoriasi, per sfatare falsi miti. Le campagne di sensibilizzazione hanno l’obiettivo di far conoscere la malattia al pubblico per ridurre la discriminazione.
Il ruolo del dermatologo e del team curante non è solo quello di prescrivere farmaci, ma anche di fornire sostegno emotivo e informazioni. Un tono di comunicazione empatico, rassicurare il paziente che non è solo (la psoriasi è comune e molte terapie funzionano), incoraggiarlo nei momenti di sconforto, sono parte integrante della cura. Può essere utile anche avvalersi di figure come l’infermiere psoriatico o il counselor se disponibili, o indirizzare a risorse quali gruppi di supporto o materiali educativi.
Infine, alcuni studi suggeriscono benefici da approcci complementari per la sfera psicologica: ad esempio tecniche di biofeedback, yoga, meditazione, o programmi di resilienza e gestione dello stress specifici per pazienti dermatologici, che possono migliorare la qualità di vita e talvolta anche il decorso cutaneo (riducendo i trigger psicosomatici).
In sintesi, la psoriasi va affrontata considerando la persona nella sua globalità: curare la pelle senza considerare l’impatto psicologico rischia di lasciare incompleto il percorso di cura. Una psoriasi ben controllata dal punto di vista clinico e un paziente supportato nella gestione emotiva sono l’obiettivo ultimo di un trattamento di successo.
Considerazioni speciali
Psoriasi in gravidanza
La gestione della psoriasi in gravidanza richiede attenzione particolare per tutelare il feto ed adattare le terapie. Innanzitutto, il decorso della psoriasi durante la gravidanza è variabile: circa un terzo delle pazienti riferisce un miglioramento spontaneo (probabilmente legato alle modifiche immunologiche della gestazione, orientate verso Th2), un terzo un peggioramento, e il resto stabilità. Dopo il parto, però, sono comuni le riacutizzazioni (post-partum flare). Dal punto di vista terapeutico, molte opzioni sistemiche sono controindicate:
- Metotrexate: assolutamente controindicato (farmaco teratogeno, categorie X) – va sospeso almeno 3 mesi prima del concepimento e in caso di gravidanza inattesa indicata interruzione a causa dell’alto rischio di malformazioni.
- Acitretina: teratogeno gravissimo (categoria X); controindicata in gravidanza e in donne in età fertile che non adottino contraccezione affidabile. Se una donna assume acitretina, deve evitare gravidanza per almeno 2 anni dopo la fine (per via della lunga persistenza del metabolita etretinato).
- Tetracicline e altri retinoidi topici (tazarotene): anch’essi controindicati in gravidanza.
- Apremilast e deucravacitinib: non ci sono dati sufficienti, se ne sconsiglia l’uso per precauzione in gravidanza.
- Fototerapia (UVB): è considerata sicura in gravidanza e rappresenta una delle scelte di prima linea per psoriasi moderata in gestante, assieme ai trattamenti topici. L’UVB non penetra oltre la pelle e non ha effetti sul feto; occorre però evitare PUVA con psoraleni orali perché i psoraleni sono teratogeni sugli animali (e comunque la PUVA comporta necessità di coprire l’addome per evitare UVA diretti sul feto).
- Corticosteroidi topici: sono utilizzabili in gravidanza, preferendo quelli a media-bassa potenza e su aree limitate. Brevi cicli di steroidi potenti su aree ristrette sono possibili se necessario, ma in generale si tende alla prudenza per evitare assorbimento sistemico significativo (alcuni studi suggeriscono basso rischio di ritardo di crescita intrauterino con uso estensivo di steroidi topici potenti; in ogni caso, posologia ponderata).
- Biologici: l’uso di farmaci biologici anti-TNF o anti-IL è una questione complessa in gravidanza. Non ci sono trial controllati per ovvie ragioni etiche, ma i dati finora (registri di casi) suggeriscono che alcuni biologici possano essere relativamente sicuri. Gli anti-TNF (soprattutto certolizumab, che grazie alla mancanza di Fc attraversa minimamente la placenta) sono stati usati in gravidanza per artrite o IBD senza evidenza di aumento di malformazioni. Molti esperti consigliano di sospendere i biologici nel terzo trimestre per ridurre il passaggio transplacentare (soprattutto IgG come adalimumab e infliximab attraversano la placenta nel 2°-3° trimestre). Secukinumab e ustekinumab hanno anche alcuni dati rassicuranti, ma in genere si valutano caso per caso: se la psoriasi è grave e non controllabile diversamente, si può considerare proseguire un biologico ritenuto “necessario”, informando la paziente dei rischi potenziali sconosciuti. L’allattamento è un’altra considerazione: molti biologici essendo grandi proteine probabilmente non passano nel latte in quantità significative, ma i dati sono limitati. In ogni caso, si tende a sospendere temporaneamente la terapia sistemica durante la gravidanza se possibile, o scegliere l’alternativa più sicura (UVB, topici). Un coinvolgimento multidisciplinare con ginecologi/perinatologi è opportuno.
Bambini e adolescenti
La psoriasi può manifestarsi già nell’infanzia (anche nei neonati, sebbene più raramente). Circa un terzo dei pazienti ha esordio prima dei 16 anni. Trattare i pazienti pediatrici presenta sfide particolari, legate sia alle differenze cliniche che alla scelta di terapie adatte all’età:
- Nei bambini piccoli, la forma più frequente è la psoriasi guttata, spesso post-streptococcica. Altre presentazioni possono simulare dermatite seborroica (psoriasi “a mantellina” del lattante, con squame su cuoio capelluto e aree sebacee) o eczemi.
- I trattamenti topici restano il pilastro iniziale: si usano steroidi a bassa-media potenza e analoghi della vitamina D con cautela (la superficie corporea rispetto al peso è maggiore nei bimbi, quindi maggior assorbimento relativo). Si evitano applicazioni troppo estese di steroidi potenti per rischio di soppressione surrenalica.
- La fototerapia NB-UVB può essere utilizzata anche in età pediatrica, con le dovute protezioni (occhiali, genitali) e collaborazione del bambino (in età scolare-adolescenziale è fattibile; nei più piccoli può essere complicato tenerli fermi). Quando praticabile, è una valida opzione prima di passare a sistemici.
- Se serve una terapia sistemica, metotrexate è spesso il preferito anche in pediatria per efficacia e familiarità d’uso (viene usato anche nell’artrite idiopatica giovanile). Si usano dosi ridotte in base al peso e si monitora attentamente la crescita e gli esami. Anche l’acitretina è stata usata nei bambini (soprattutto per pustolosi ereditarie), ma va ponderata per effetti su crescita ossea e per la questione futura fertilità nelle ragazzine.
- I farmaci biologici sono ora approvati per la psoriasi pediatrica in molti paesi: ad esempio Etanercept è approvato dai 6 anni in su per psoriasi, Ustekinumab dai 12 anni, Secukinumab dai 6 anni per psoriasi a placche grave, Ixekizumab da 6 anni, Adalimumab anche intorno ai 4-6 anni per l’artrite pediatrica (off-label in psoriasi). I dati pediatrici mostrano un profilo di sicurezza simile all’adulto. L’uso di biologici nei bambini con psoriasi severa è quindi una realtà nei centri specialistici, specialmente se la malattia compromette la qualità di vita (es. coinvolgimento viso o esteso). Naturalmente si considerano sempre prima le terapie convenzionali salvo che il quadro clinico giustifichi l’impiego precoce di un biologico.
- Un aspetto fondamentale è il supporto psicologico e educativo: un bambino con psoriasi può essere soggetto a prese in giro a scuola o difficoltà relazionali. Bisogna spiegare alla famiglia e agli insegnanti la natura non contagiosa e aiutare il bambino a capire e accettare la sua condizione. Coinvolgere i genitori nella gestione (ad es. applicazione di creme come routine quotidiana) in modo da alleggerire per il bimbo il peso della terapia.
La psoriasi pediatrica può regredire alla pubertà in alcuni casi, ma non c’è garanzia. A volte persiste nell’età adulta. È importante un follow-up anche in transizione all’età adulta, assicurando continuità di cure (es. trasferimento a dermatologo dell’adulto se necessario). In sintesi, nel bambino si preferiscono approcci meno invasivi possibile, ma senza esitare a trattare in modo adeguato le forme che impattano su crescita e benessere del piccolo paziente. La collaborazione con i genitori è cruciale per il successo terapeutico.
Psoriasi nell’anziano
Nei pazienti anziani (≥65 anni) la psoriasi pone considerazioni specifiche principalmente per la presenza di comorbidità e la maggiore sensibilità agli effetti collaterali dei farmaci. Aspetti da considerare:
- Molti anziani psoriasici hanno una storia di malattia di lunga data, trattata magari con molteplici approcci nel corso della vita. Può esserci presenza di comorbidità multiple (cardiopatie, insufficienza renale, epatopatie, ecc.) che rendono alcune terapie sistemiche rischiose. Ad esempio il methotrexate in un 75enne con fegato steatosico e diabete potrebbe non essere ideale; la ciclosporina in un iperteso con funzione renale ridotta pure. I biologici in generale sono meglio tollerati dall’anziano rispetto agli immunosoppressori tradizionali, ma bisogna considerare un possibile aumentato rischio infettivo (l’anziano è più suscettibile a infezioni, quindi monitorare attentamente).
- Gli anziani spesso assumono molti farmaci concomitanti: attenzione alle interazioni farmacologiche. La ciclosporina ha interazioni con farmaci comuni (antipertensivi, statine), l’acitretina sommata ad altri iperlipidemizzanti può peggiorare colesterolo, ecc. Un’accurata anamnesi farmacologica e aggiustamenti posologici sono necessari.
- Fototerapia: può essere usata nell’anziano se in buone condizioni generali, ma bisogna considerare la mobilità ridotta (difficoltà a stare in piedi in cabina, o a recarsi frequentemente in ospedale se limitazioni di trasporto). Inoltre, la pelle anziana è più secca e fragile, quindi predisposta a prurito post-UV o a danni attinici cumulativi; comunque NB-UVB rimane una opzione se logisticamente fattibile.
- Topici: rimangono importanti anche nell’anziano, ma attenzione a possibili problemi di aderenza (alcuni anziani faticano ad applicare creme in zone difficili da raggiungere, es. dorso, per limitazioni fisiche). È utile coinvolgere caregiver o famiglia nell’aiuto per l’applicazione se necessario. Si preferiscono preparazioni semplici da usare e magari polivalenti (es. combinazione calcipotriolo/betametasone) per ridurre il numero di applicazioni.
- Un aspetto particolare è che nell’anziano è più frequente la polimorbidità dermatologica: pelle secca senile, eczemi asteatosici, prurito cronico, che possono coesistere con la psoriasi e confondere il quadro. Si può avere anche sovrapposizione di psoriasi ed eczema da contatto (allergie da farmaci topici applicati a lungo). Serve quindi un occhio attento per gestire eventuali patologie cutanee concomitanti.
In termini di terapia sistemica, i biologici vengono sempre più usati anche negli anziani con psoriasi grave, perché non presentano tossicità d’organo cumulativa come MTX o ciclosporina. Studi ed esperienza clinica suggeriscono che i biologici mantengono un buon profilo di sicurezza anche oltre i 65-70 anni, sebbene il paziente vada monitorato strettamente per infezioni opportunistiche (es. herpes zoster, motivo per cui può essere indicato vaccinare per lo zoster prima di iniziare la terapia in quell’età). Il dosaggio dei biologici non cambia con l’età (non essendo farmaci con range terapeutico ristretto e non essendo eliminati per via epatica/renale in modo significativo).
In definitiva, nella psoriasi dell’anziano il principio è “start low and go slow”: iniziare con dosi basse dove possibile, monitorare di frequente, ed essere pronti a modificare la terapia ai primi segni di effetti avversi. La sicurezza assume un ruolo ancora più centrale, bilanciando sempre il beneficio di controllare la malattia (che comunque negli anziani può essere debilitante, specie se pruriginosa o estesa) con il rischio tollerato. Con le dovute cautele, anche i pazienti anziani possono beneficiare delle terapie moderne e ottenere un ottimo controllo della psoriasi, migliorando la loro qualità di vita.
Fonti: Linee guida EADV/EDF EuroGuiDerm, AAD-NPF e NICE; StatPearls NCBI; JEADV; Cutis 2024; dati epidemiologici internazionali e letteratura su comorbidità e altre fonti citate nel testo.